Cette actualité est parue il y a plus de 90 jours, elle est susceptible de ne pas être pertinente pour vous. Nous vous invitons à consulter nos actualités plus récentes en cliquant ici.
EMA : le projet DADI en route
18 octobre 2022
MédicamentFlashback. C'est en décembre 2020 que l'Agence européenne du médicament (EMA) a initié la refonte du format de dépôt des variations et autorisations de mise sur le marché (AMM). Concrètement, les formulaires de demande électronique (eAF) laissent place à une interface digitale. Début de l’opération ? Octobre 2022 pour une mise en place progressive de la plateforme tout au long de l’année 2023. Nom du projet ? DADI, ou Digital Application Dataset Integration.
Ce que cela implique pour vous, industriels ?
Concrètement, pas grand-chose :
- Les données à intégrer ne changent pas
- Vous continuez de déposer vos AMM et variations auprès des autorités européennes, dans le cadre des procédures centralisées. Les procédures de dépôts restent inchangées.
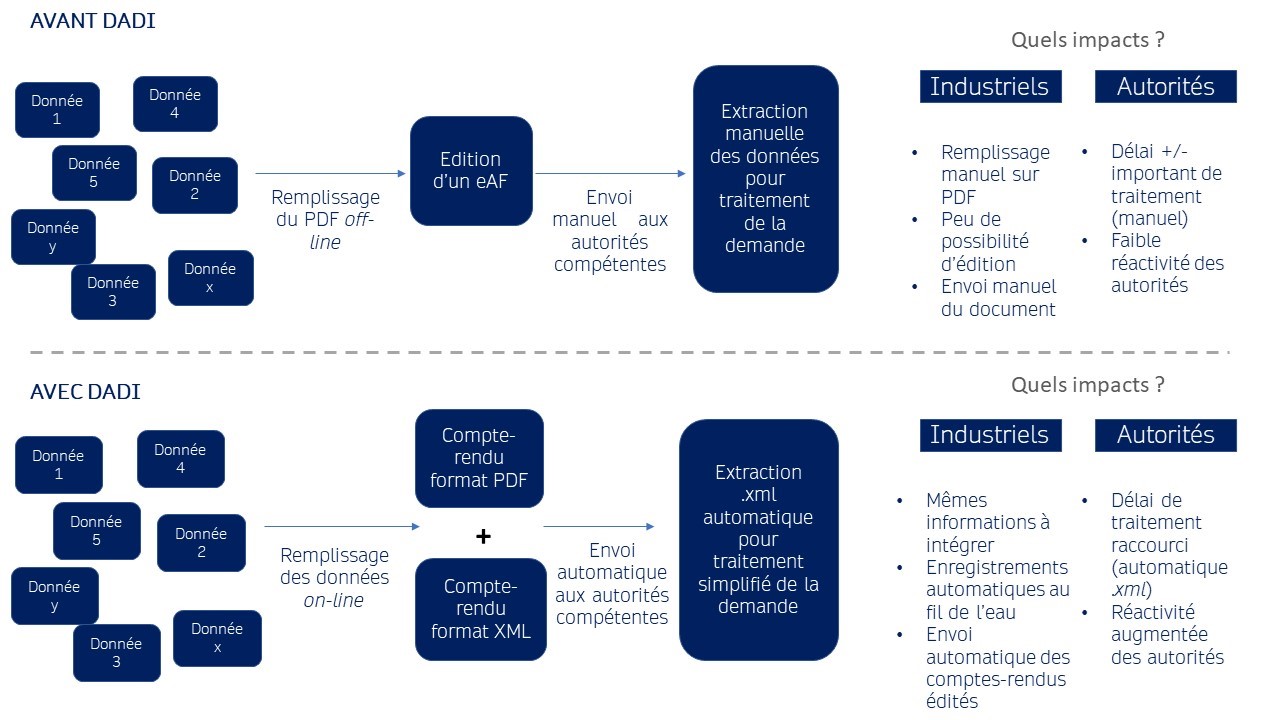
En d’autres mots, le projet DADI impacte la forme des dépôts sans toutefois en altérer le fond. Il facilite le renseignement de vos données : plutôt que de compléter les informations sur des PDF, vous remplissez un formulaire en ligne proposant :
- De véritables outils d’éditorialisation (mise en gras, souligné, taille de police, etc.) ;
- Des zones de texte pré-remplies, améliorées, permettant d’ajouter beaucoup de textes, des illustrations, des tableaux, etc.
Vous avez un volume important de données à renseigner ? Pas de panique, des sauvegardes s’effectuent automatiquement durant le processus d’enregistrement.
À l’issue du dépôt digital de la variation et/ou de l’AMM, vous disposerez de comptes rendus en formats PDF (semblables aux eAFs) et XML (facilitant le traitement des données renseignées).
À noter que la signature de ces comptes rendus n’est pas obligatoire à ce jour, ni électronique ni scannée. À suivre tout de même...
Qui peut renseigner les données sur le portail ?
Les accès sont sécurisés. Dans un souci de traçabilité, le dépôt des demandes doit s’effectuer par un collaborateur de l’entreprise inscrit sur la plateforme, en fonction de ses attributions et de ses droits d’édition sur celle-ci.
Vous avez donc la main en interne sur les collaborateurs à inscrire sur la plateforme ainsi que sur le paramétrage de leurs accès et droits respectifs.
Quels formulaires sont concernés par le nouveau dispositif ?
À l’heure où ces lignes sont écrites, seul le formulaire dédié aux variations liées aux médicaments à usage humain est concerné, notamment dans le cadre des procédures d’enregistrement centralisées (CAPs).
D’ici le dernier trimestre 2023, d’autres formulaires doivent être développés : variations pour les médicaments à usage vétérinaire, dépôt et renouvellement d’AMM.
Pourquoi cette refonte ?
- Premièrement, le nouveau formulaire, entièrement digitalisé, répond mieux aux normes ISO IDMP (Identification of Medicinal Products), c’est-à-dire aux standards internationaux en matière d’identification et d’échange des informations liées aux médicaments.
- La deuxième raison est d’ordre technologique. Les formulaires PDF manuels (eAF) sont désormais considérés comme inadaptés aux usages modernes. Le formulaire web permettra « des améliorations progressives de la convivialité pour les utilisateurs ». Ce work in progress concerne notamment les bases de données de produits et de substances : les listes déroulantes de substances prendront moins de temps à charger au fil du temps et seront moins confusantes.
- Troisième raison : la rapidité. Le changement de format s’inscrit dans un objectif « d’efficacité » et donc, de réactivité et de réduction des délais. Un exemple : « les formulaires prendront en charge la validation des demandes par les autorités compétentes, réduisant les erreurs et les divergences ».
- Dernière raison : l’interopérabilité. Les nouveaux formulaires permettront l’homogénéisation des données. « Les formulaires faciliteront l’introduction de données normalisées et structurées dans des bases de données ». Ce qui favorisera « l’interopérabilité des systèmes et le partage de données entre les différentes autorités concernées ».
Quid des AMM au Royaume-Uni ?
Brexit oblige, il n’y a plus de passerelle entre l’EMA et la Medicines and Healthcare products Regulatory Agency (MHRA) ; l’équivalent de l’ANSM au Royaume-Uni. Les titulaires d’AMM au Royaume-Uni ne pourront donc pas utiliser DADI.
|
Vous souhaitez mieux appréhender les procédures d’enregistrement ? Connaître les attentes des autorités réglementaires et répondre à leurs demandes ? Des questions abordées dans les formations suivantes :
|